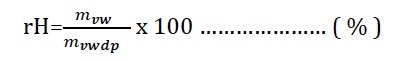4. PSİKROMETRİK ÖZELLİKLER VE TERİMLER
3.1. Giriş
Üç temel piziki öge belirlendiği ve sabit olduğu sürece kuru hava ile su buharının karışımı sabittir ve değişemez. Bu ögeler şunlardır:
a) Barometrik basınç (veya irtifa)…………………………..( Patm)
b) Kuru termometre sıcaklığı………………………………….( tdb)
c) Aşağıdaki üç değişkenden herhangi biri
- Yaş termometre sıcaklığı veya…………………( twb )
- Bağıl nem veya………………………………………(rH )
- Çiy noktası………………………………………………( tdp)
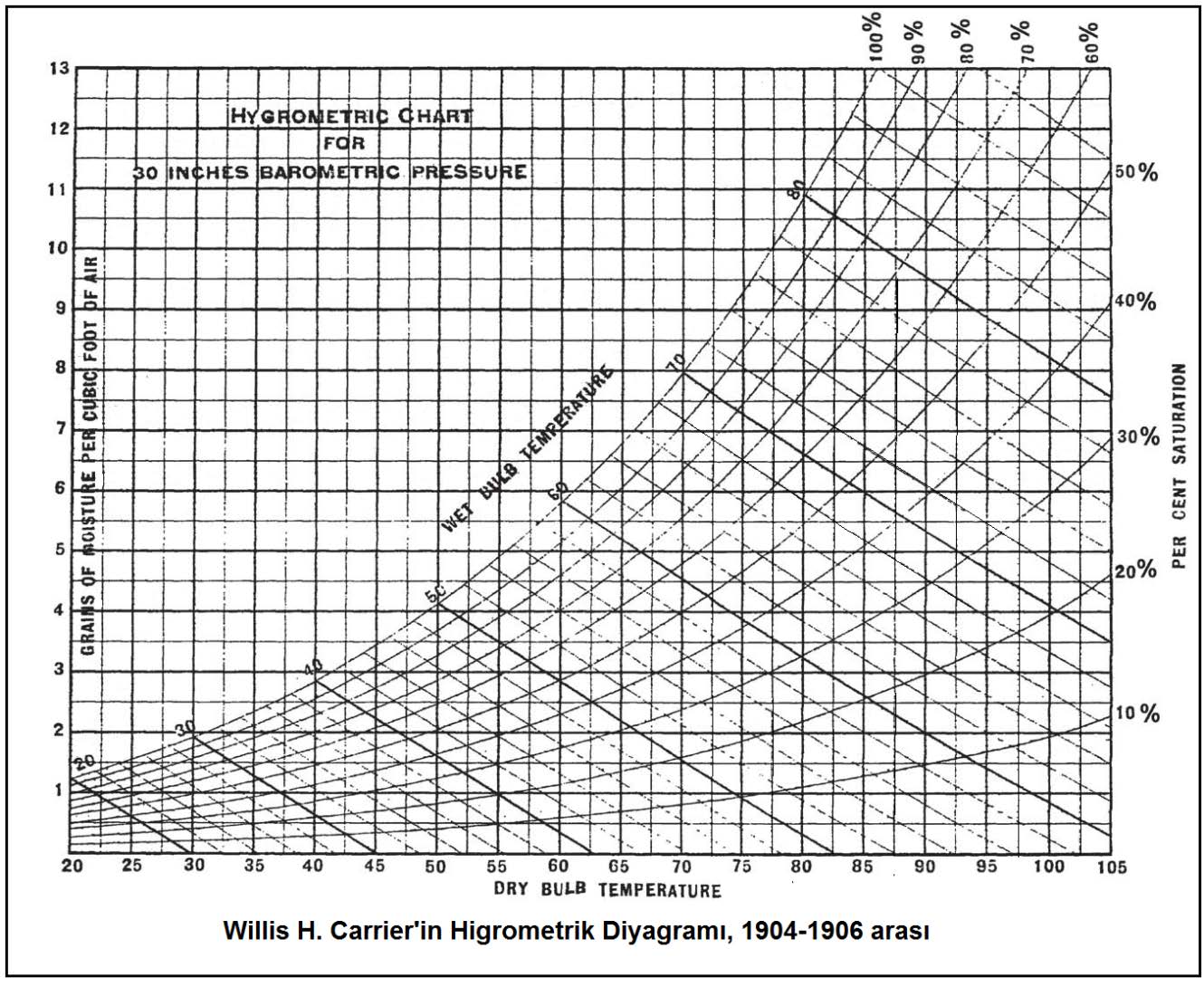
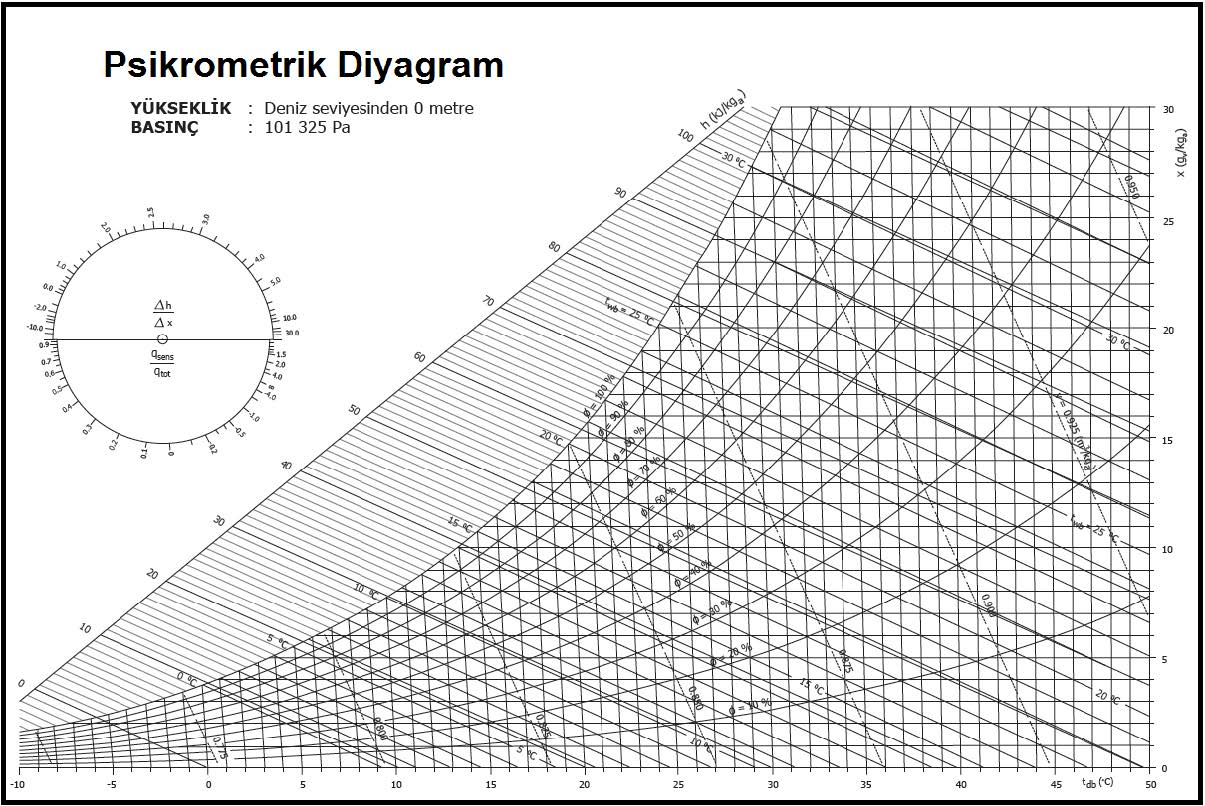
“c” şıkkındaki üç unsur birbirine bağlı olduğu için “a”,”b” deki ögelerle “c” deki ögelerden birinin belli ve sabit olması kuru hava ile su buharı karışımının durumunu da belirler ve sabitler. Bu husus aynı zamanda “c” şıkkındaki diğer iki değişkeni de belirler ve sabitler. Bu özellikler aşağıdaki psikrometrik diyagramda gösterilmiştir.
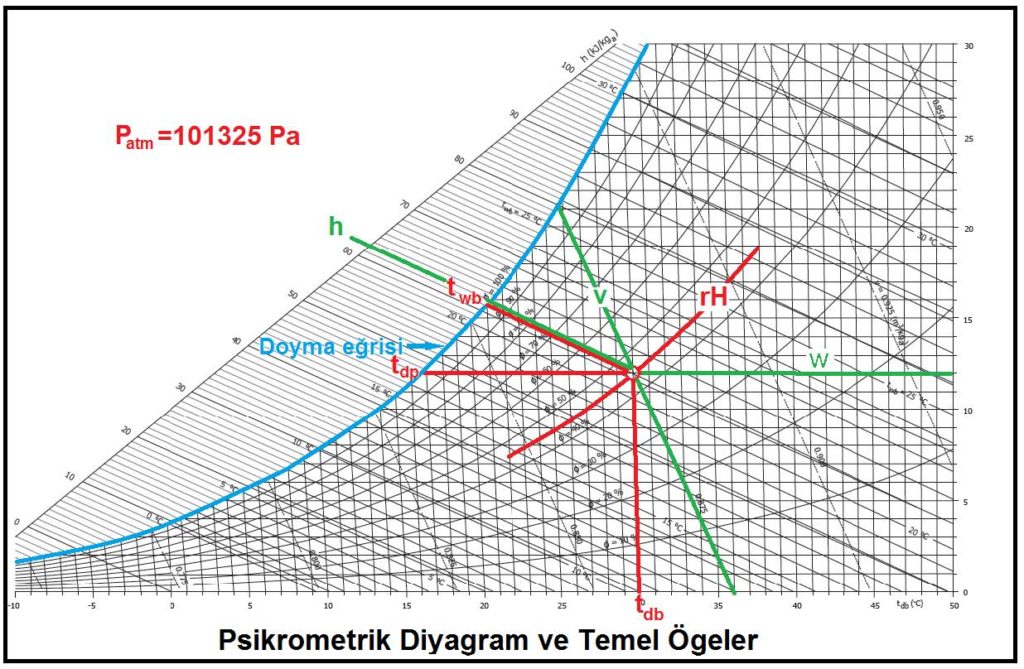
Bu diyagramda temel psikrometrik konumu belirleyen ögeler kırmızı renkte gösterilmiştir. Bu ögelerin yardımıyla diğer önemli üç doneyi de psikrometrik diyagramdan okumak mümkündür. Bu doneler şunlardır:
- Entalpi ……………………………………………………( h)
- Mutlak nem…………………………………………….(w )
- Özgül hacım……………………………………………( v )
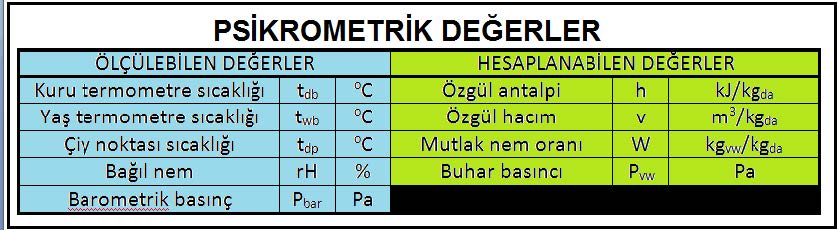
Bu sayede dokuz temel nokta belirlenmiş olmaktadır. Bu noktalardan beşine ölçülebilen değerler, diğer dördüne de hesaplanabilen değerler diyebiliriz. Bu husus aşağıdaki tabloda özet olarak gösterilmektedir.
 3.2. Kuru Termometre Sıcaklığı
3.2. Kuru Termometre Sıcaklığı
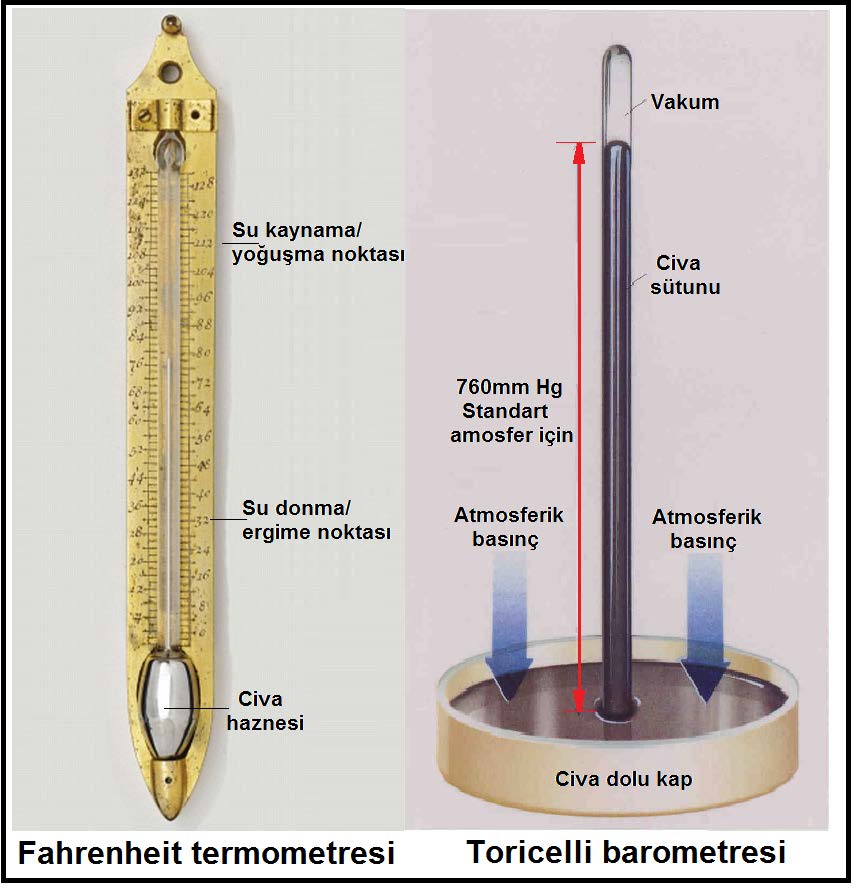
Kuru termometre sıcaklığı herhangi bir alkollü ve civalı termometre ile veya aynı değerlere kalibre edilmiş hissedici+transduser ile ölçülen mahal veya çevre sıcaklığıdır. Bu sıcaklık “tdb” sembolü ile gösterilir. Birimi ise “oC”veya “K”dir. Daha önceki bahislerde anlatıldığı gibi “oC” Celsiyus skalası olup bu skalada 0oC deniz seviyesinde suyun donma sıcaklığına, 100oC ta deniz seviyesinde suyun kaynama noktasına tekabül etmektedir. “K” ile gösteriklen Kelvin ölçeği ise mutlak sıfırı esas almıştır, bu sıcaklık Selsiyus skalasında -273.15oC’a eşittir.
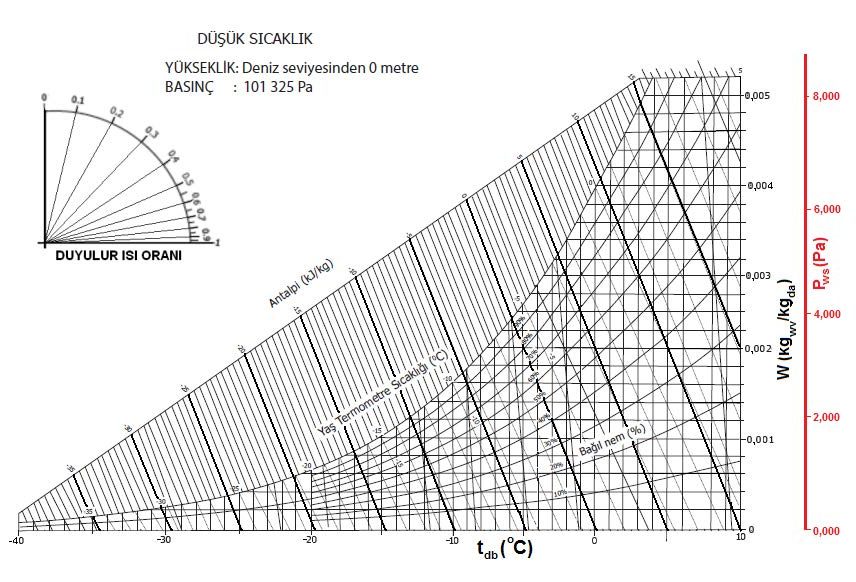
Kuru termometre sıcaklığı psikrometrik diyagramda “oC” olarak diyagramın altında , absisinde yer alır ve düşey hatlar ile gösterilir.
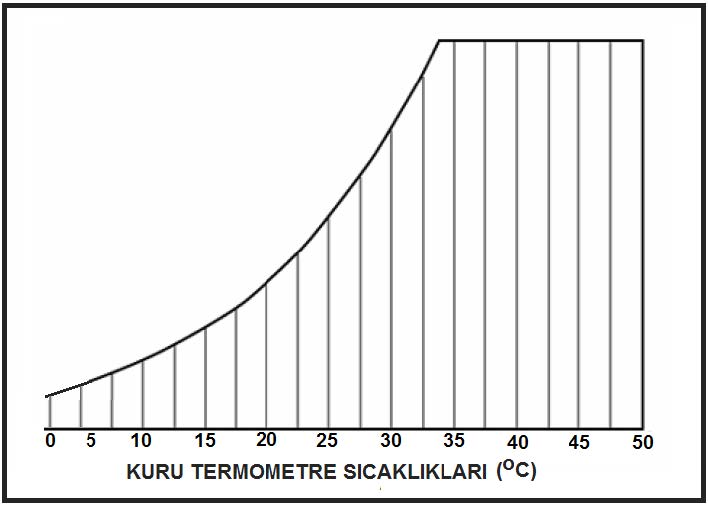
Kuru termometre sıcaklığı gösteren absiste 0oC kuru hava sıcaklığı aynı zamanda entalpik değerlerin başlangıç, yani referans noktası olarak kabul edilir ve bu noktadan itibaren kuru havanın entalpik değerleri hesaplanır. Bu hesaplamayı aşağıdaki formüller ile gösterebiliriz.
Q=M. Cp-da(t2db-t0)
Bu denklemde “t0” havanın entalpik hesaplamada referans noktası olan 0oC sıcaklığı, “t2”iseentalpisinin ölçülmesi istenen kuru havanın sıcaklığını göstermektedir. “Cp-da” değeri ise havanın özgül ısısıdır; birimi “kJ/kg”dır.
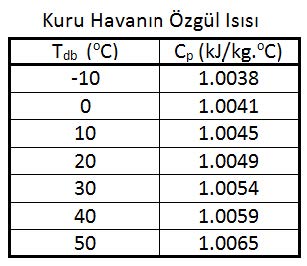
Cp-dakuru havanın özgül ısısıdır. Özgül ısı bir kilogram ağırlığındaki bir nesnenin ısısını 1oC arttırmak için gerekli olan ısıdır. Bu değer 15oC’taki bir kilogram suyun ısısını bir derece arttırmak için gerekli olan ısıya orantılı olarak belirlenir. Bu değer kCal/h birimleriyle su için 1.00 kCal/kg, kuru hava için 0.24 kCal/kg’dır. Uluslararası kullanımda olan “SI” birimleriyle ifade edildiğinde kuru havanın özgül ısısı 1.00483 kJ/kg’dır. Su buharının özgül ısısı da 1.83’dür. Havanın özgül ısısı kuru termometre sıcaklığına bağlı olarak çok az değişiklik göstermektedir. 1.00483 kJ/kg değeri esas alındığında -10oC ile +50oC arasında yapılacak hesaplarda hata payı %0.2’den küçük olmaktadır. Aşağıdaki tabloda “Cp” değerindeki değişmeler gösterilmektedir.
Aynı şekilde su buharının özgül ısısında da aynı sıcaklık aralığında çok küçük, kabili ihmal farklılıklar olmaktadır.
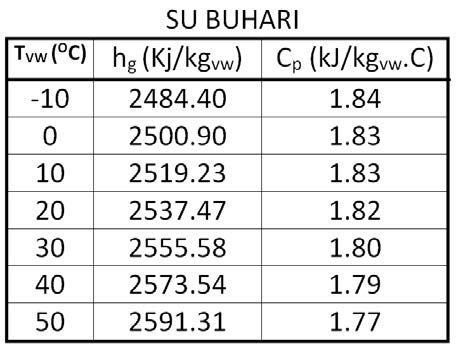
Dolayısıyla su buharının özgül ısısını 1.82 kJ/kg.C olarak kabul edebiliriz.
Bir önceki sayfadaki formülü birim kitle, 1 kg kuru hava için yaptığımızda kuru havanın “t2” sıcaklığındaki antalpisini hesaplamış oluruz.
h2da=Cp-da(t2db-t0)
Doymuş havanın entalpisini de kuru havanın entalpisi ile doyma noktasındaki mutlak nem oranının buharın özgül ısının çarpımının toplamı olarak bulabiliriz.
h2sa=Cp-da(t2db-t0) + Cp-vw.W(t2db-to)
h2sa=t2-da(Cp-da+ Cp-vw.W) …………………………(kJ/kg)
3.3. Yaş Termometre Sıcaklığı ve Adyabatik Doyma
Yaş termometre ile ilgili birçok tarif vardır. Bunlardan biri yaş termometre sıcaklığını “buharlaşma sıcaklığı” olarak, diğer bir tarif te “%100 doyma noktasına gelinmesi ile neticelenen evaporatif soğutma neticesi elde edilebilen en düşük sıcaklık” olarak tarif eder. Termodinamik yaş termometre sıcaklığına aynı zamanda adyabatik doyma sıcaklığı da denmektedir.
Yaş termometre sıcaklığı “termodinamik yaş termometre sıcaklığı” ve “psikrometrik yaş termometre sıcaklığı”olarak ta tarif edilmektedir. Termodinamik yaş termometre sıcaklığı suyun buharlaşması ile havanın adyabatik olarak soğuması sonucu elde edilebilen en düşük sıcaklıktır. Sıvı haldeki su doymamış hava ile temas ettiğinde kısmi buhar basıncı farkı nedeniyle buharlaşır (bu konu ileriki bahislerde detaylı bir biçimde incelenecektir) . Bu buharlaşma işlemi adyabatik bir prosestir. Çünkü dışarısıyla hiçbir ısı alış-verişi yoktur. Buharlaşma için gerekli ısı havadan temin edilir ve bunun neticesi olarak hava soğur ama içindeki mutlak nem oranı artar. Neticede hava-buhar karışımının antalpik değeri sabit kalır.
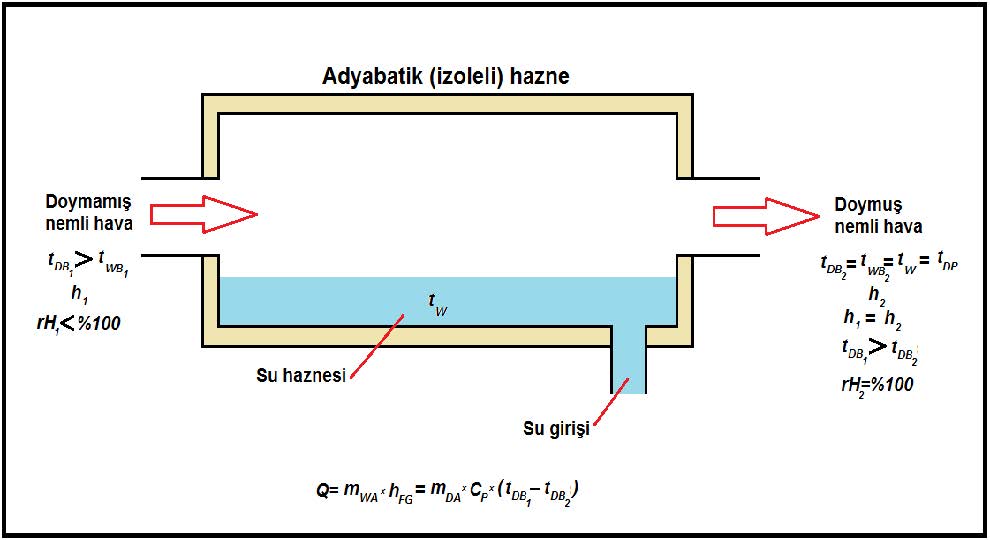
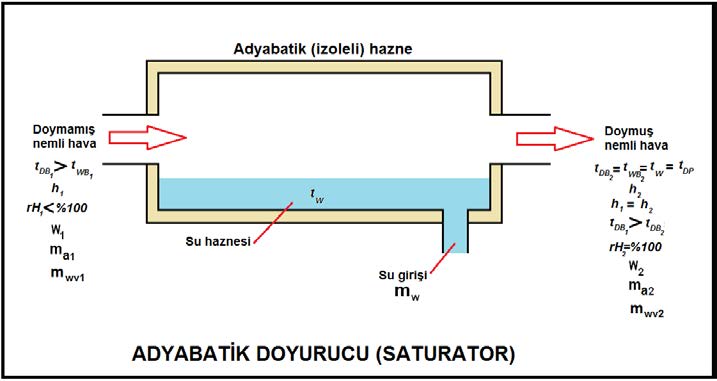
Termodinamik yaş termometre sıcaklığı adyabatik doyurucudaki kitle ve enerji balansları dikkate alınarak ölçülür. Bu nedenle termodinamik yaş termometre sıcaklığına adyabatik doyma sıcaklığıda denir. Adyabatik doyurucu olarak adlandırılan enstruman aslında teoretik bir enstruman olup mutlak izolasyona sahip olması ve çok uzun (sonsuza yakın) bir boyda olması gerekir.
Mollier Diyagramı’nda ve 1963’den itibaren ASHRAE’in Psikrometrik Diyagramları’nda izometrik çizgiler halinde gösterilen yaş termometre sıcaklığı çizgileri bu ölçme tekniği ile belirlenen termodinamik veriler esas alınarak tanzim edilmiştir. Aşağıdaki resimde adyabatik doyurucunun şematik bir çizimi yer almaktadır.
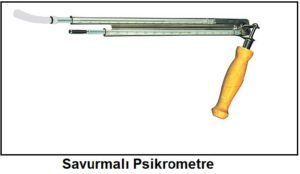
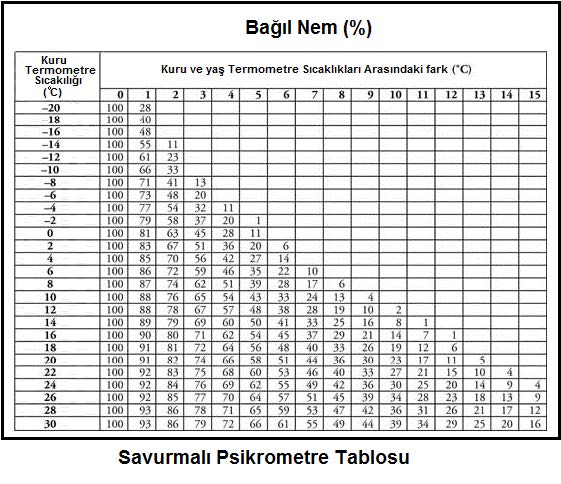
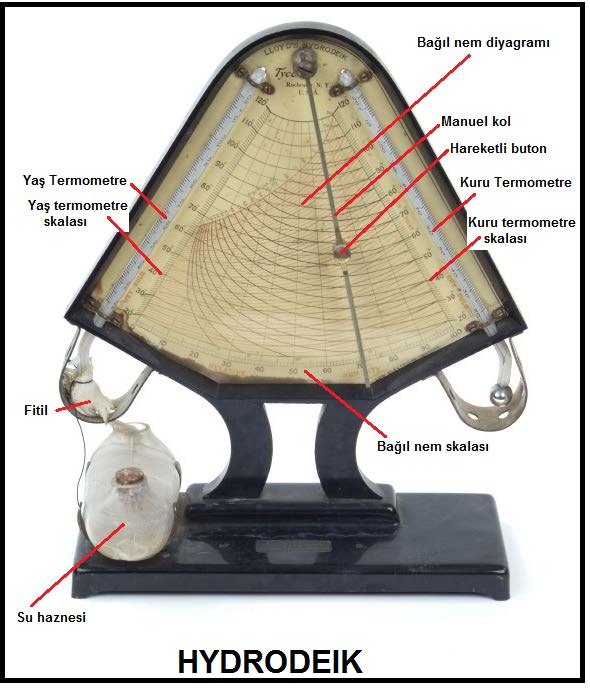
Kuru hava ve su buharı karışımı ile belirlenen psikrometrik yaş termometre sıcaklığı klasik bir termometrenin, örneğin cıva veya alkollü cam termometrenin hissedici ucunun yumuşak ve temiz bir pamuk sarılması, pamuğun iyice ıslatıldıktan sonra 3 ila 5 m/s hava hızına tabi tutulması ile ölçülür. Islatılmış uç üzerinden geçen hava akımı suyun buharlaşmasına ve termometrede gösterilen sıcaklığın düşmesine neden olacaktır. Bir müddet sonra ölçme kararlı rejime giriiecek, termometrede görünen değer sabitlenecektir. Bu değer psikrometrik yaş termometre sıcaklığıdır. Bu ölçme işlemi esnasında termometrenin ve özellikle ucunun güneş radyasyonuna maruz bırakılmaması gerekir. Ölçme ucunu kaplayan pamuk devamlı ıslak tutulmalıdır. Bunun için pamuğun fitil tarzında uzatılması ve bir su haznesine batırılmış olması gerekir (bkz. Bölüm-1 HYDRODEIK). Benzer bir yaş termometre psikrometresi aşağıdaki resimde gösterilmektedir.

Kuru termometre ile yaş termometre sıcaklıkları rarsındaki farkın (tdb-twb) 10oC’tan büyük olması fitilin hareket halindeki hava ile teması esnasında ısınmasına ve bu ısının hazneye iletilerek suyun bir miktar ısınmasına neden olur. Böyle durumlarda ölçülen yaş termometre sıcaklıkları olması gereken değerlerden biraz yüksek çıkabilir.
Buradaki işlem adyabatik doyurucudaki işlemin birebir aynı değildir. Ancak psikrometrenin uygun bir yere yerleştirilmesi koşuluyla iki ölçüm arasındaki sapmalar ihmal edilebilecek minimum seviyelerde tutulabilir.
Adyabatik Doyurucu’da yapılan işlemi termodinamiğin iki temel kanununun ışığı altında inceleyebiliriz. Adyabatik doyurucuya giren kuru havanın debisi “ma1”, çıkan havanın debisi de “ma2” gösterilmektedir. Buharlaşan su miktarı da “mw” dir. “w1”ve “w2” giriş ve çıkıştaki havanın içindeki mutlak nem oranını göstermektedir. Kitlenin korunumu kanununa göre denklemimizi kurarsak:
ma1=ma2=ma……………………………..(kuru havanın debisi)
mwv1+mw=mwv2…………………………..(havadaki buharın debisi)
Bu denklemi su buharı için aşağıdaki gibi de yazabiliriz.
ma.w1+ mw= ma.w2
Böylece:
mw=ma(w2-w1)…………………………….. (buharlaşan suyun debisi)
Benzer denklemleri de enerjinin korunumu kanununa göre yazabiliriz.
∑m1.h1=∑m2.h2
Bu denklemde “m1” girişteki doymamış nemli havanın kütlesini, “m2”ise çıkıştaki doymuş nemli havanın kütlesini, “h1” ve “h2”ise aynı havaların giriş ve çıkıştaki antalpilerini, “hwv1” ve “hwv2” su buharının giriş-çıkıştaki entalpilerini, “hw”ise suyun entalpisini göstermektedir. göstermektedir. Buradaki eşitliğin nedeni prosesin adyabatik olmasından, dışarı ile herhangi bir enerji transferi olmamasından kaynaklanmaktadır.
Aynı denklemi şöyle de yazabiliriz:
ma.h1+ mw.hwv2 = ma.h2
ma.h1+ ma(w2-w1).hwv2 = ma.h2
Bu denklemi “ma” kemiyetine böldüğümüzde aşağıdaki denklemi buluruz.
h1+ (w2-w1).hwv2 = h2
(Cp.tdb1+ w1.hwv1)+(w2-w1)hw2=(Cp.tdb2+w2.hvw2)
w1=(Cp(tdp1-tdp2)+w2.hvw2)/(hwv1-hw2)……bulunur.
Daha önceki hesaplarımızda “mwv/mda”mutlak nem oranını aşağıdaki gibi hesaplamıştık:
mwv/mda=0.621945. Pwvs/(P- Pwvs)
mwv2/mda=w2 olduğuna göre yukarıdaki denklemde “w1”değerini yerine koyduğumuzda “w1” değerini de hesap yoluyla bulmuş oluruz.
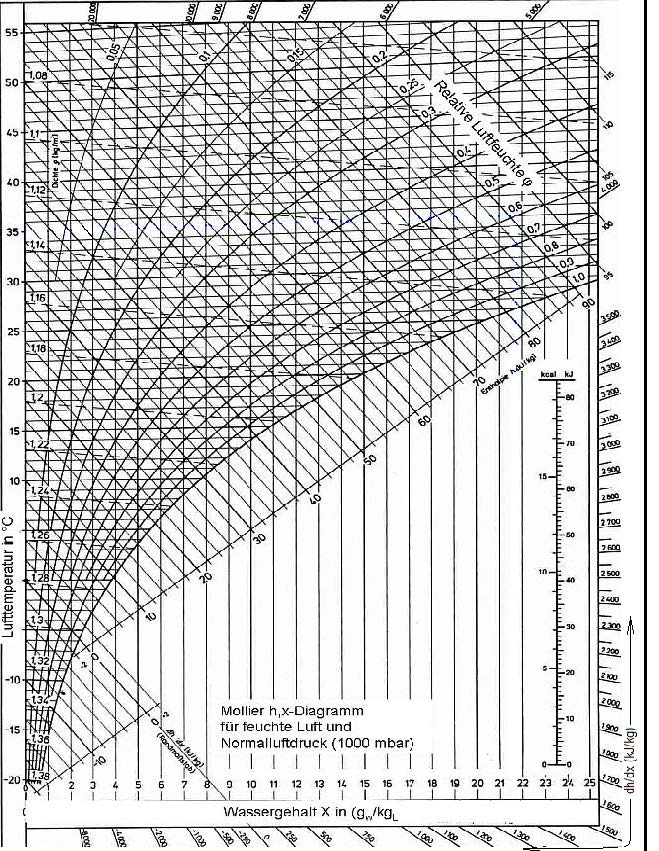
Yaş termometre sıcaklıkları ASHRAE’in psikrometrik diyagramlarında ve Mollier’in i-x diyagramında birbirine paralel eğimli düz çizgiler olarak gösterilir. Bu çizgiler sabit antalpi çizgilerine de paraleldir.
- Çiy Noktası ve Çiy Noktası Sıcaklığı
Çiy noktası sıcaklığını satıh kondansasyonunun oluşmaya başladığı sıcaklık olarak tarif edebiliriz. Benzeri bir tarif ile, çiy noktasını havanın doyma noktasına eriştiği, daha fazla buhar kabul edemeyeceği sıcaklık olarak ta tanımlayabiliriz. Eğer buhar ilave edilmeye devam edilirse sis, satıh yoğuşması veya bulutlar oluşmaya başlar.
Çiy noktasının daha ilmi bir tarifi de yoğuşabilir herhangi bir buharın sabit basınçta yoğuşma başlamadan önce erişebileceği sıcaklıktır. Dolayısıyla doyma sıcaklığı ile çiy noktası sıcaklığı birbirine eşit anlamdaki tabirlerdir.
Çiy noktası sıcaklığını basit bir deneyle kendimiz de yapabiliriz.
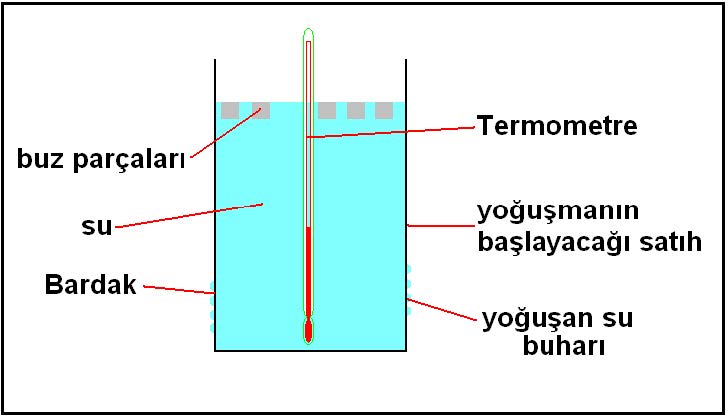
Bir bardağın içine oda sıcaklığında su kouyn. İçine de bir termometre daldırın. Bardağın içine azar azar buz ilave edip termometredeki düşmeyi izleyin. Bir süre sonra bardağın dış sathında su zerrecikleri belirmeye başlayacaktır. Bu zerrecikler yoğuşan havadaki su buharıdır. Yoğuşmanın başladığı andaki sıcaklık değeri de odanızın çiy noktasıdır.
Herhangi bir kuru termometre ve yaş termometre sıcaklıkları ile belirlenen ortam soğutulmaya başlandığında önce duyulur soğutma işlemi gerçekleşir (Bkz. Bölüm-5, konu 5.4.1 ve 5.4.2). Belirli bir sıcaklığa gelindikten sonra mahal havasının içindeki buhar da yoğuşmaya başlar ve bu noktadan itibaren duyulur ve gizli soğutma işlemleri beraber devam eder.
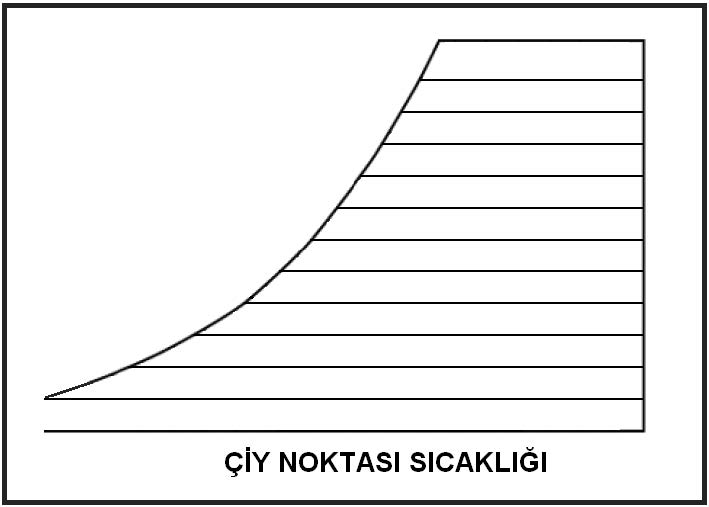
Çiy noktası mahal şartlarından kuru termometreyi belirleyen absise paralel bir çizginin çizilmesi ile bulunur. Bu çizginin doyma eğrisini kestiği nokta o ortamın çiy noktası sıcaklığıdır. Bu sıcaklık doyma noktası sıcaklığına eşittir.
Aynı zamanda bu noktanın kuru termometre ve yaş termometre sıcaklıkları da eşittir.
3.5. Bağıl Nem
-40oC ila +65oC arasındaki sıcaklıklarda yapılan deneyler su buharının ideal gaz karakteristiklerine sahip olduğunu göstermiştir. Bu görüş açısından hareketle bağıl nemi ortam şartlarında mevcut mutlak nem oranının aynı kuru termometre sıcaklığındaki mutlak nem oranına oranı olarak ifade edebiliriz. Bağıl nem için kulanılan simge “rH” olup “%” olarak ifade edilmektedir ve birimsiz bir kemiyettir.
rH (%)= (Wt1/Wdp.t1).100
Aynı orantıyı (kısmi) buhar basınçlarının oranı olarak ta ifade edebiliriz.
rH (%)=(Pwv-t1/Pwv-dp-t1).100
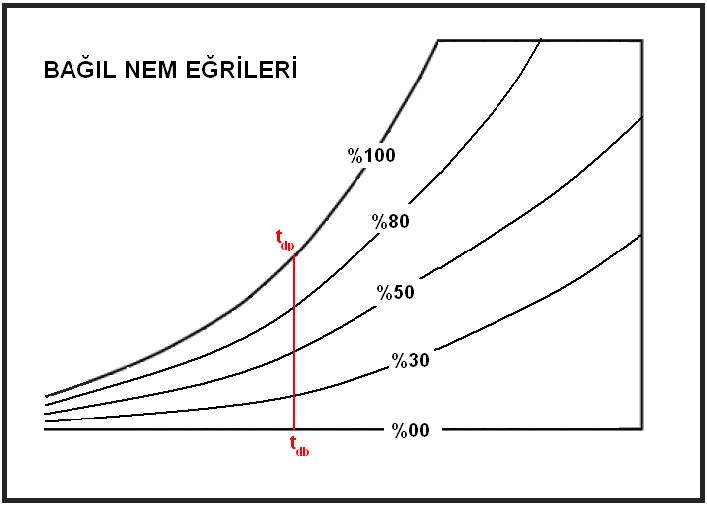
Yukarıdaki psikrometrik diyagramdan da anlaşılacağı gibi “tdb”kuru termometre şartlarındaki bir ortamda olabilecek mutlak nem oranı (miktarı) sıfır ile “tdp”nin tekabül ettiği nem oranı arasında değişiklik gösterebilmektedir. Belirtilen sıcaklıktaki mutlak nem miktarının yüzde ellisi “rh%50”i,yüzde sekseni “Rh%80”i, yüzde otuzu da “Rh%30”a tekabül etmektedir.
Burada bilinmesi gereken bir olay vardır. Gün batımına yakınlaştıkça bağıl nem oranı artar. Bu işlem havanın duyulur soğuma işlemine tabi olmasından kaynaklanmaktadır. Havadaki mutlak nem değişmediğinden soğumaya bağlı olarak bağıl nem oranı artış gösterir. Bu soğuma devam eder ve çiy noktası sıcaklığının altına düşerse, örneğin arabalarımızın camlarında gördüğümüz su zerreciklerini görürüz. Eğer sıcaklık 0oC’ın altındaysa çiy yerine kırağı ile karşılaşırız.
3.6. Barometrik Basınç
Basınç bir birim alana onun üzerindeki kütlenin ağırlığı ile tatbik olunan kuvvete verilen isimdir. Aynı şekilde barometrik basıncı da herhangi bir belirgin konumda birim alana üzerindeki havanın ağırlığı ile tatbik olunan kuvvet olarak tarif edebiliriz. Psikrometrik proseslerde barometrik basınç ile atmosferik basınç eş anlamlı olarak kullanılmaktadır.
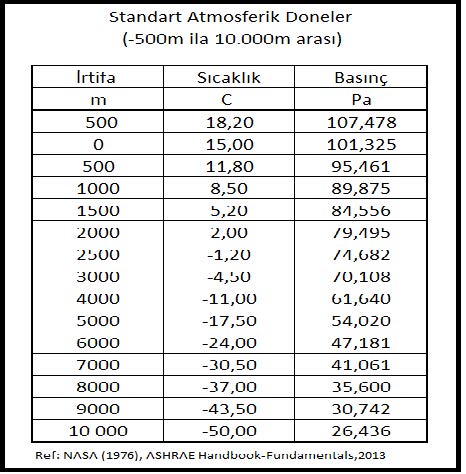
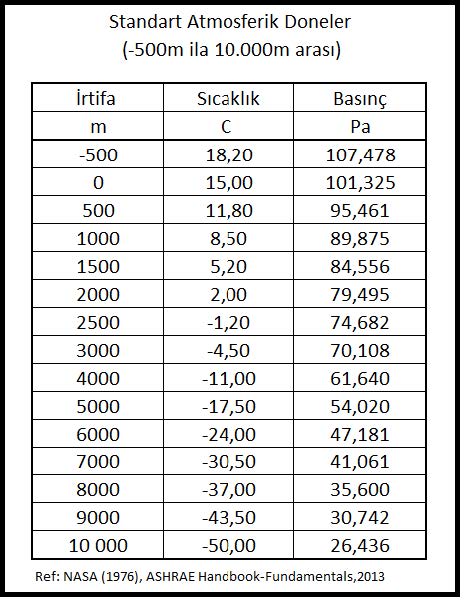
Barometrik basınç deniz seviyesinden olan irtifa ile değişmektedir. Atmosferin belirli bir kalınlığı olduğu kabulü ile barometrik basıncın deniz seviyesinden derinlere inildiğinde artacağı, yükseklere çıkıldığında da azalacağı kolaylıkla anlaşılabilir. Barometrik basınç “barometre” olarak adlandırdğımız, genelde cıva içeren bir ölçme aleti ile ölçülür. ASHRAE STP tarifine göre deniz seviyesindeki basınç 29.92 inHg, 760mmHg veya 101.325 kPa (kilopaskal)’dır. Günümüzde cıvalı barometrelere ilaveten körüklü “aneroid” tipi veya spiralli mekanik barometreler ve elektronik dijital barometreler de kullanılmaktadır.
Eğerbelirli bir noktadaki barometrik basınç bilinmiyorsa, basıncı ICAO (Uluslar arası Sivil Havacılık Kurumu)’nun 1925 yılında yayınlamış olduğu formüle göre hesaplamak mümkündür. Konu 2.4.1’de vermiş olduğumuz formülü tekrar veriyoruz.
Pbar= 101.325 (1-2.25577 x 10-5x Z)5.2559……….(kPa)
Buformülde “Z” metre cinsinden irtifayı göstermektedir. İrtifaya bağlı olarak basınç ve sıcaklık değerlerinin değişimi Konu-2.4.1’deki “Standart Atmosferik Doneler” tablosunda -500m ila 10 000m arasındaki irtifalar için gösterilmektedir.
Barometrik basınç kuru havanın basıncıyla su buharının basıncının toplamından oluşmaktadır. Herhangi bir belirgin konumdaki barometrik basıncı birim alan üzerindeki havanın ağırlığı ile tatbik olunan kuvvet olarak tarif etmiştik. Ancak havanın özgül hacminin artması ki bu genellikle sıcaklık artışına bağlı olarak meydana gelir, kuru hava basıncının azalmasına neden olur. Barometrik basınç sabit olduğuna göre eksilen kısmi basıncı su buharı tamamlayacaktır.
Pbar= Pda + Pwv
Diğer bir yaklaşımla, kuru havanın basıncındaki değişikler barometrik basıncı oluşturan ikinci ögeyi etkilediğini, bu nedenle kuru hava kısmi basıncının azalması su buharı kısmi basıncının artmasına neden oluşturduğunu söyleyebiliriz. Aynı şekilde kısmi kuru hava basıncındaki artışlarda kısmi buhar basıncında eksilmelere neden oluşacağı, bu işlemin de havadaki su buharının yoğuşması suretiyle gerçekleşeceği psikrometrinin temel oluşumlarından biridir.
Psikrometrik prosesler esnasında barometrik basıncın sabit olduğu kabul edilir. Tüm klima hesaplarında bu husus aynen kabul edilmekte, meteorolojik olaylar neticesi barometrik basınçta meydana gelebilecek küçük değişmeler kabili ihmal kabul edilmektedir.
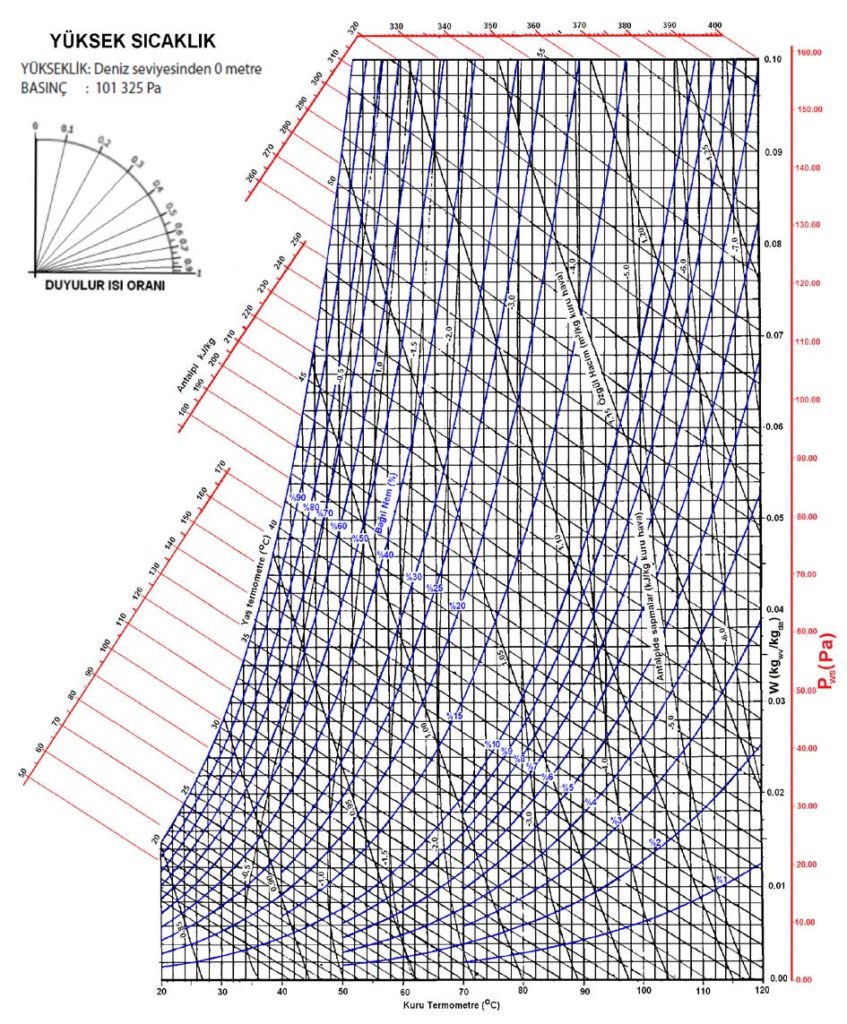
Barometrik basınç psikrometrik özelliklerin belirlenmesi ve sabitlenmesi için gerekli üç temel ögeden biridir. Diğer ögelerin başında kuru termometre sıcaklığı ile yaş termometre sıcaklığı gelir. Yaş termometre sıcaklığı yerine mutlak nem oranını veya bağıl nemi de kullanabilirsiniz. Barometrik basınç psikrometrik diyagramlarda bir koordinat olarak yer almaz. Ancak her barometrik basınç için ayrı bir psikrometrik diyagramın çizilmesi gerekir. Bu nedenledir ki ASHRAE deniz seviyesi (101.325 kPa) için ayrı, 750 metre (92.834 kPa) için ayrı, 1500 metre (84.556 kPa) için ayrı ve 2250 metre (77.058 kPa) için ayrı psikrometrik diyagramlar tanzim etmiştir. Bu diyagramlar 4. Bölüm’de detaylı olarak incelenecektir.
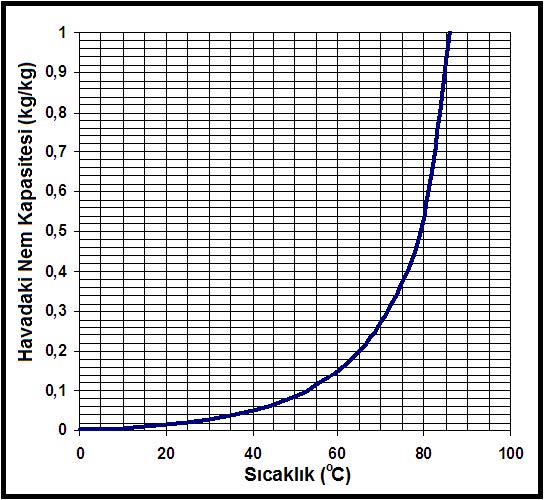
Barometrik basıncın irtifa nedeniyle azalması da hava içinde bulunabilecek mutlak nem oranını etkilemektedir. Basıncın düşmesi neticesi kısmı buhar basıncı ve buna bağlı olarak mutlak nem oranı artmaktadır. Bu değişikliği aşağıdaki diyagramda görebiliriz.
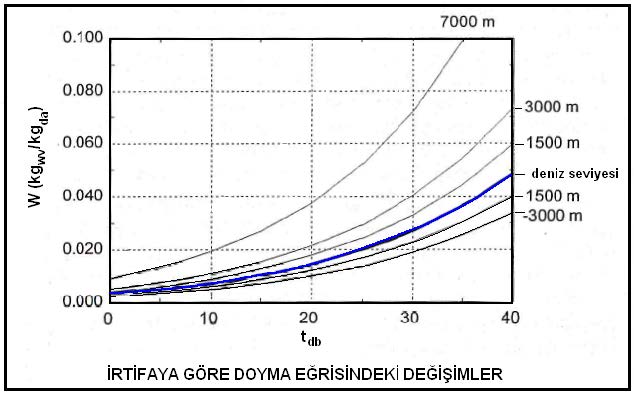
Ref.:Understanding Psychrometrics, Donald P. Gatley, ASHRAE
3.7. Özgül Hacim
Özgül hacim psikrometride kuru havanın birim kitlesinin işgal ettiği hacim olarak tarif edilir. Birimi beher kilogram başına düşen metreküp olup “m3/kgda” olarak gösterilir sembolü de “v” harfidir. Dalton Kanunu’na göre kuru havanın, su buharının ve nemli havanın işgal ettikleri hacimler birbirine eşittir. Bu nedenle salt “v” ile iktifa edilir ve alt simge kullanılmaz.
Psikrometrik diyagramda özgül hacim eğimli düz çizgiler olarak gösterilir.
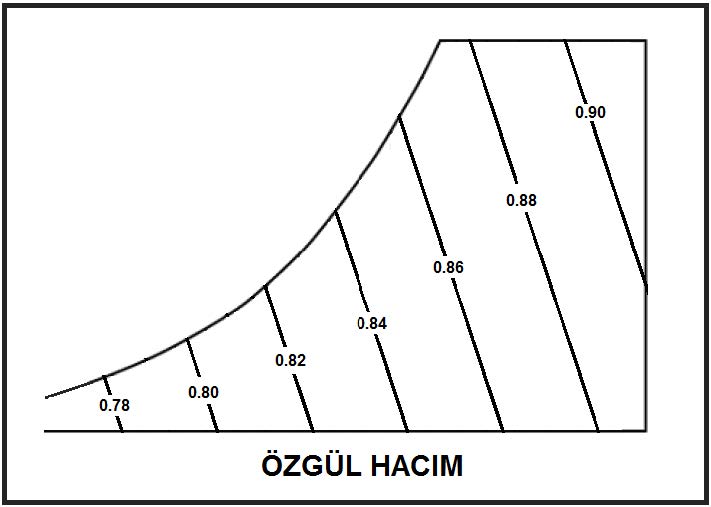
Psikrometrik özgül hacmin tarifi içinde kuru hava ile su buharından başka gazlar dikkate alınmamaktadır. Bu nedenle psikrometrik özgül hacim bilimsel özgül hacim tarifinden az da olsa farklılık içermektedir. Psikrometride özgül hacim nemli havanın hacminin kuru havanın kitlesiyle bölünmesiyle bulunur (m3/kgda). Ancak diğer bilimsel uygulamalar için özgül hacim tüm elemanları içeren hacmin aynı elemanları içeren birim kütleye bölünmesiyle elde edilir. İdeal gazları Dalton Kanunu’nun ışığı altında incelediğimizde karışımı meydana getiren kuru havanın ve su buharının aynı hacmi işgal ettiklerini görürüz. Bunu denklem olarak yazdığımızda:
Vda/mda=Vwv/mda=Va/mda
Bu denklemde:
V= hacim……………………… m3
M= kitlesel ağırlık…………kg’dır.
Bu nedenle aynı denklemi özgül hacim açısından aşağıdaki gibi yazabiliriz:
vda=vwv=va
Bu eşitlik eşit kuru termometre şartlarında geçerlidir.
Özgül hacim ideal gazlarla ilgili denklemlerle de ifade edilebilir:
Pda. v =Rda. T
ve
Pda= Pbar-Pwv
Bu iki denklemden hareketle aşağıdaki sonuçlara varırız:
v=(Rda.T)/(Pbar-Pwv)
v=(287.042)(tcelcius+273.15)/(Pbar-Pwv)
Daha önce,konu 2.4.4’de aşağıdaki eşitlik bulunmuştu
W=0.621945 . pwv/(pbar – pwv)
Bu eşitliği yukarıdaki denkleme yerleştirdiğimizde aşağıdaki sonuca ulaşırız:
v=(287.042)(tcelcius+273.15).(1 +1.60786W)/Pbar….m3/kgda
3.8. Mutlak Nem Oranı
Mutlak nem oranı birim hacimdeki kuru hava içinde bulunan nem miktarıdır. Aynı zamanda kısaca mutlak nem olarak ta ifade edilen bu bulgu şu şekilde ifade edilebilir. Mutlak nem oranı deniz seviyesinden olan yüksekliğin bir fonksiyonudur. Bu husus aşağıdaki hesaplarda da görülmektedir.
W=mwv/mda……………………………….(kgvw/kgda)
Bu formülde:
W : Mutlak nem oranı
mwv: Su buharı kitlesi…………………………..kgvw
mda: Kuru hava kitlesi………………………….kgda
Psikrometrik diyagramda mutlak nem oranı yatay çizgiler olarak gösterilmektedir.
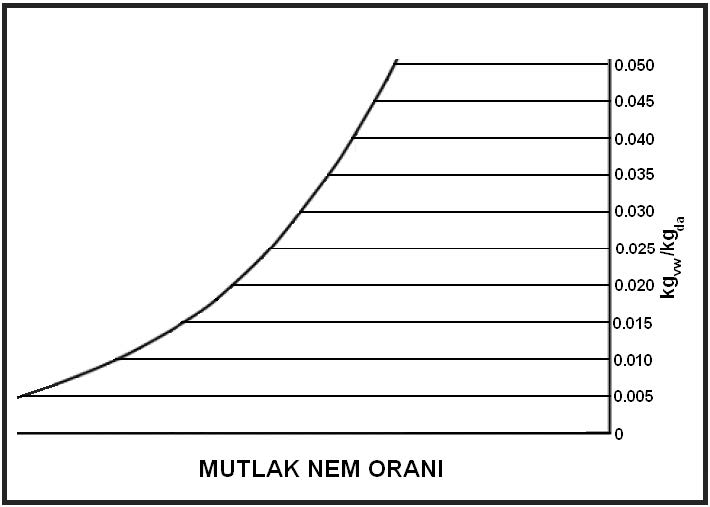
Mutlak nem oranı “W”, su buharı kısmi basıncı “Pwv” ve bağıl nem “rH” arasındaki münasebetleri aşağıdaki gibi belirleyip bu münasebetlerden yola çıkarak mutlak nem oranını hesap yoluyla bulabiliriz. İlk öce ideal gazlarla ilgili genel denklemimizi yazalım, sonra bunlara alt simgeler uygulayarak bu denklemleri su buharı ve kuru hava için tekrarlayalım.
P.V = m.R.T
m= (P.V)/(R.T)
mda= (Pda.Vda)/(Rda.Tda)
mwv= (Pwv.Vwv)/(Rwv.Twv)
Rda= 287.06 J/kg.K)……………… (Bkz. Konu 2.2.4)
Rwv= 461.51 J/kg.K)……………… (Bkz. Konu 2.3.1)
(mwv/mda)=W=((Pwv.Vwv)/(Rwv.Twv))/((Pwv.Vwv)/(Rwv.Twv))
Bu son denklemde Vwvile VdaDalton kanununa göre eşittirler.Çünkü aynı hacmı paylaşmaktadırlar. Aynı şekilde Tdaile Twvda birbirine eşittir. Bu eşitliklerin birbirini götürmesi halinde formülümüz aşağıdaki şekle döner.
W=((Pwv)/(Rwv.))/((Pwv)/(Rwv))
W=(Pwv.Rda)/(Pda.Rwv)
W=287.06Pwv/461.51Pda
W=0.622 (Pwv/Pda)………………. Bulunur.
Pbar= Pda+ Pwv……………………….Pda=Pbar-Pwv……………olduğuna göre:
W=0.622 Pwv/(Pbar-Pwv)………………………………bulunur.
Bu son formüle göre mutlak nem oranının, başka bir ifade tarzıyla bir metreküp kuru hava içinde bulunabilecek nem miktarı atmosferik basıncın bir fonksiyonudur. Atmosferik basınç azaldıkça birim kuru hava hacmi içindeki mutlak nem oranı artar. Bu husus Konu 3.9’daki “İrtifaya Göre Doyma Eğrisindeki Değişimler” diyagramında açıkça görülmektedir.
3.9. Buhar Basıncı
Buhar basıncı, atmosferik basıncı meydana getiren kısmi basınçlardan biridir. Bunu daha önceki bahislerde görmüştük. Bu hususu aşağıdaki gibi formülize edebiliriz.
Pbar=PN2+Po2+PAr+………………………+Pwv
Bu formülde “Pwv” su buharı basıncını, diğerleri ise atmosferi oluşturan sair gazların basıncını ifade etmektedir. Deniz seviyesinde atmosferik basıncın psikrometrik prosesler açısından sabit olduğunun kabul edildiği belirtmiştik. Bu duruma göre deniz seviyesindeki basıncı şöyle de yazabiliriz.
Pbar=Pda+Pwv=101.325 kPa
Bu bağlantıdan iki husus anlaşılmaktadır.
- Kuru havanın basıncındaki artmalar ve eksilmeler buhar basıncını belirler.
- Atmosferik basıncın deniz seviyesinden olan yüksekliğe bağlı olarak değişmesi hem kuru hava kısmi basıncını hem de su buharı kısmi basıncını etkiler.
Kısmi buhar basıncını mutlak nem oranına bağlı olarak şu şekilde hesaplayabiliriz:
W=0.622Pwv/(Pbar-Pwv)…………….(bkz. Bölüm-3, konu 3.8)
Pwv=1.6077W(Pbar-Pwv)
veya
Pwv= W(162.90 – 1.6077Pwv) …………………….(bulunur)
Deniz seviyesinde doyma noktasındaki buhar basıncı da Pbar’ın yerine 101,325 Pa değerini koymakla bulunur.
Değişik irtifalar için kısmi buhar basıncını değişik bir yöntemle aşağıdaki gibi hesaplayabiliriz. Bunun için Bölüm-2 , konu 2.4.1’deki basınç hesaplama formülünü “Pwv” formülüne monte etmemiz gerekir.
Pbar=101.325(1 – 2.25577 x 10-5x Z )5.2559….dolayısıyla
Pwv=1.6077W(101.325(1 – 2.25577 x 10-5x Z )5.2559-Pwv)
Bu formülde “Z” metre cinsinden deniz seviyesinden yüksekliği göstermektedir.
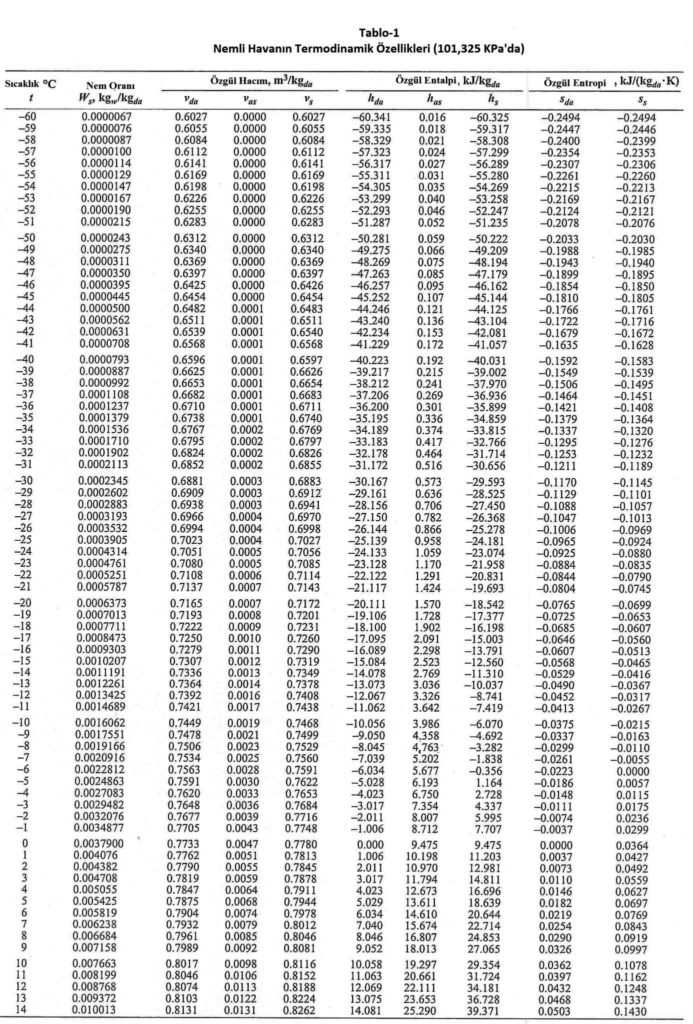
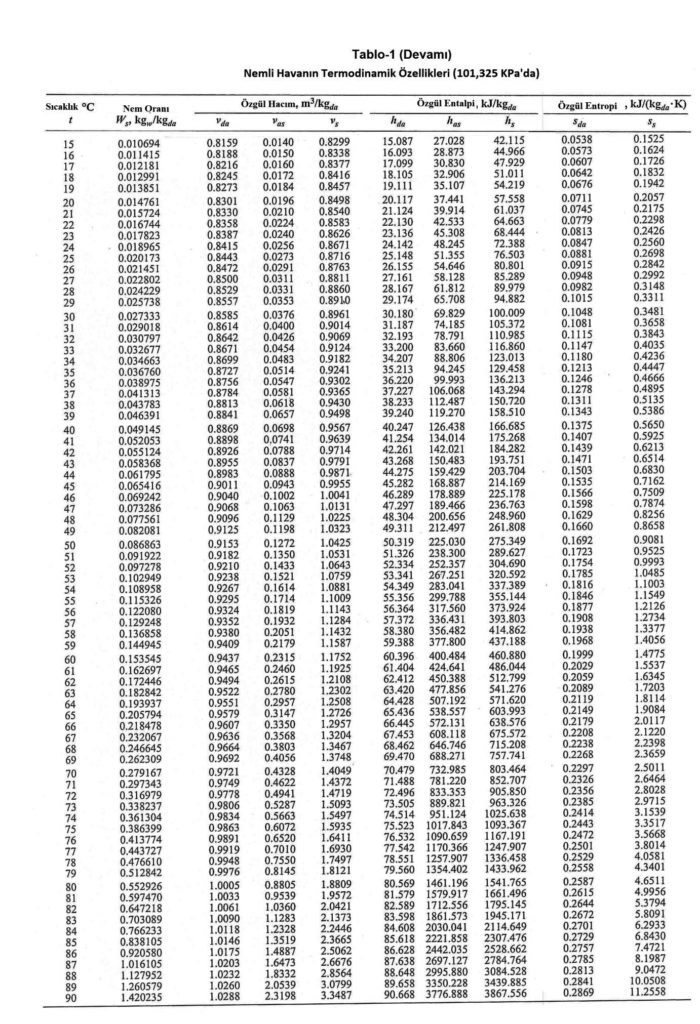
Aynı noktadan hareketle Bölüm-2 konu 2.4.3’deki empirik formülü kullanarak deniz seviyesinde, değişik sıcaklıklardaki doymuş buhar basınçlarını hesapladığımızda aşağıdaki tablodaki değerleri buluruz.
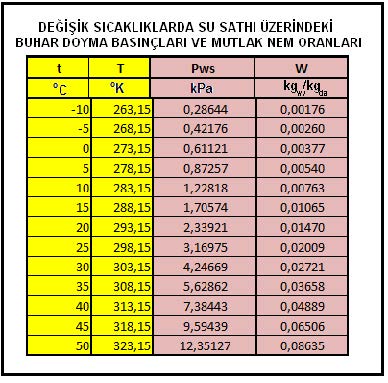
Yukarıdaki tablodan ve formüllerden de görüldüğü gibi buhar basıncı ile mutlak nem oranı birbiri ile birinci dereceden doğru orantılıdır. Bu noktadan hareketle psikrometrik diyagramda buhar basıncı ve mutlak nem çizgilerinin doğrular tarzında, birbirlerinme paralel olduğu, aynı zamanda absise de paralel olduğu anlaşılır. Bu durum aşağıdaki şematik çizimde gösterilmektedir.
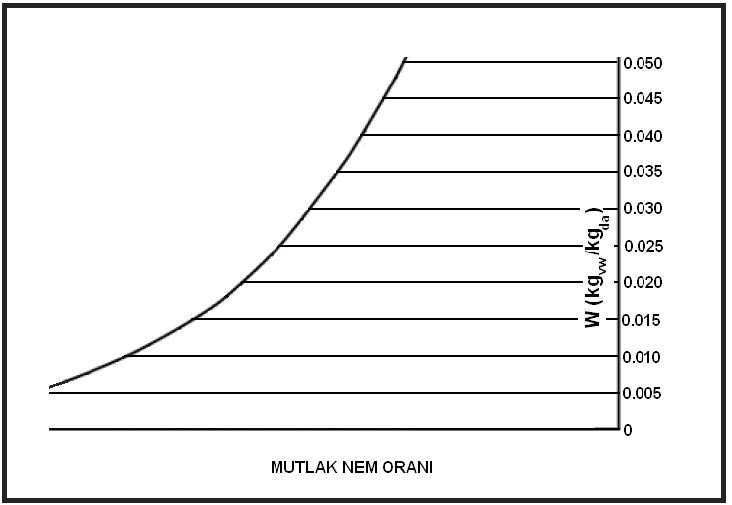
3.10. Özgül Entalpi
Entalpi maddenin yapısında depolanan her türlü enerjinin toplamıdır. Ancak maddelerin kesin entalpilerinin hesaplanması oldukça zordur. Bu yüzden çalışmalarda entalpik değer olarak birim kütledeki maddenin, belirli bir referans noktasından mevcut sıcaklığa yükselebilmesi için gerekli olan enerji ile faz değiştirmesi için gerekli olan enerjinin toplamına denir. Sıcaklık yükselmesi için gerekli entalpi “kJ/kg.” olarak ifade edilir. Keza aynı durum buhar için de gereklidir. Ayrıyeten sabit sıcaklıkta faz birim kitlenin faz değişimi için gerekli ısıya da prosese bağlı olarak buharlaşma antalpisi veya yoğuşma antalpisi denir.
Birim kütleye sahip maddelerin birim sıcaklık artımı için gerekli ısıyı alabilme kapasitesine “özgül ısı” denir. Önceki yıllarda 1 kilogram suyun sıcaklığının 1oC artması için gerekli ısı miktarı 1 kCal/oC.kg kabul edilmiş ve değer arı suyun özgül ısısı olarak kabul edilmişti. Bu kabulden hareket ederek diğer sıvı, katı ve gaz konumundaki maddelerin sabit basınç altındaki özgül ısıları “cp” belirlenmişti. Günümüzde artık“SI” birimleri kapsamında “kJ/kg.oC” kullanılmakta ama aynı orantı mantığı devam etmektedir.
Antalpi “h” sembolü ile ifade edilir. Kuru hava için bunu aşağıdaki gibi formülize edebiliriz.
hda=cp(Δt)……………………………….kJ/kg
Kuru havanın antalpik ölçümleri için 0oC noktası referans alınmıştır. Bu sıcaklığıjn altındaki kuru hava antalpileri “-“, üstündekiler ise “+” olarak ifade edilmektedir. Bu açıdan konuya baktığımızda yukarıfaki formül şu şekli alır:
hda=cp(t) .……………………………….kJ/kg
Önceki bahislerde, örneğin bu bölümde konu-3.2’de kuru hava ve su buharı için özgül ısı değerleri verilmiştir. Bu değerleri kullanarak kuru havanın entalpisini hesaplamak mümkündür. Ancak psikrometrinin incelediği hava salt kuru hava olmayıp kuru hava ile su buharının karışımından meydana gelmektedir. O zaman havanın antalpisi şu şekilde ifade dilebilir:
ha= hda+W.hwv.……………………………….kJ/kg
Bu formülde:
ha= Nemli havanın entalpisi……………….kJ/kg
hda= Kuru havanın entalpisi……………….kJ/kg
hwv= Su buharının entalpisi…………….….kJ/kg
W = Mutlak nem oranı………………………kgwv/kgda
Yaklaşık denklemler olarak, havanın özgül ısısının 1.006 kJ/kg.oC kabulü ve “hwv” değerinin kuru termometre sıcaklığına bağlı aşağıdaki denklemle hesaplanacağını kabul edersek havanın entalpisini aşağıdaki denklemlerle hesaplayabiliriz (ref. Pyschrometrics, Theory & Practice, ASHRAE, 1996, formül No 1.7.21, 1,7,22 ve 1.7.23=;
hwv= 2501 + 1.805t
ha= 1.006t+W.(2501 + 1.805t)………………………..kJ/kg
Yaş termometre sıcaklığı ile ilgili bölümde suyun hava içinde buharlaşmasının adyabatik bir proses olduğunu, dışarıdan herhangi bir enerji almadığını, buharlaşmak için gerekli olan ısıyı kuru havadan aldığını belirtmiştik. Başka bir tabirle yaş termometreyi belirleyen işlemlerde su buhar karışımının başlangıçta ve nihayette antalpik değerlerinin aynı kaldığını söylemiştik. Bu nedenle özgül entalpi hatlarının belirli bir eğimde düz çizgiler olduğunu ve bu çizgilerin yaş termometre çizgilerine paralel olduğunu söyleyebiliriz.
Bunun tek istisnası havaya püskürtülen suyun aşırı soğutulması veya aşırı ısıtılmasıdır ki bu durumda proses çizgisi artık sabit entalpi hatlarına paralel olmaz. Bu konuyu 5’inci Bölüm “Psikrometrik Esasların Uygulanması”da detaylı bir biçimde inceleyeceğiz.
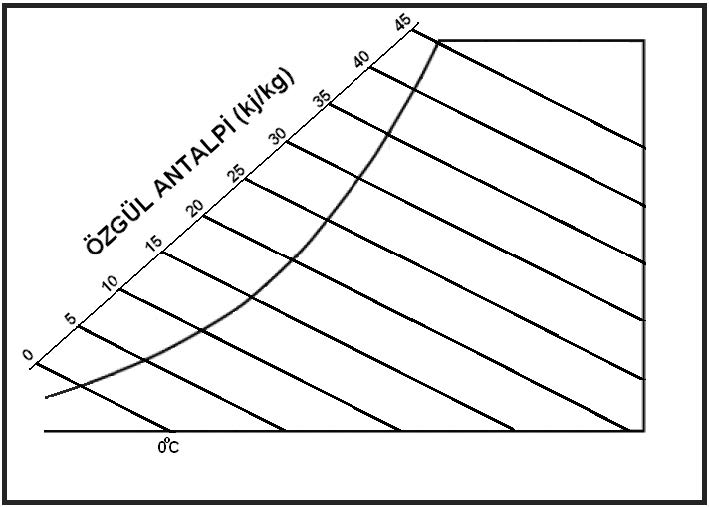
3.11. Özgül Entropi
Termodinamiğin ikinci yasasına aynı zamanda entropi de denir. Düzensizlik entropi ile eş anlamlıdır. Entropi termal işlemlerde yönü belirler. Örneğin suyun yukarıdan aşağı, ısının sıcaktan soğuğa akması gibi. “s” sembolüyle gösterilen özgül entropi sisteme ilave dilen birim enerjinin “dQ” zamana bölünmesinin integraline eşittir . Gibbs teorisine göre gaz karışımının entropisi onu meydana getiren elemanların entropilerinin toplamına eşittir.
sa=sda+ W.swv……………………………………………………………………..kJ/kg.oK
Psikrometrik proseslerde ilmi çalışmalara dışında pek karşılaşmayacağınız bu konuya salt bilgi açısından değinmekle yetineceğiz
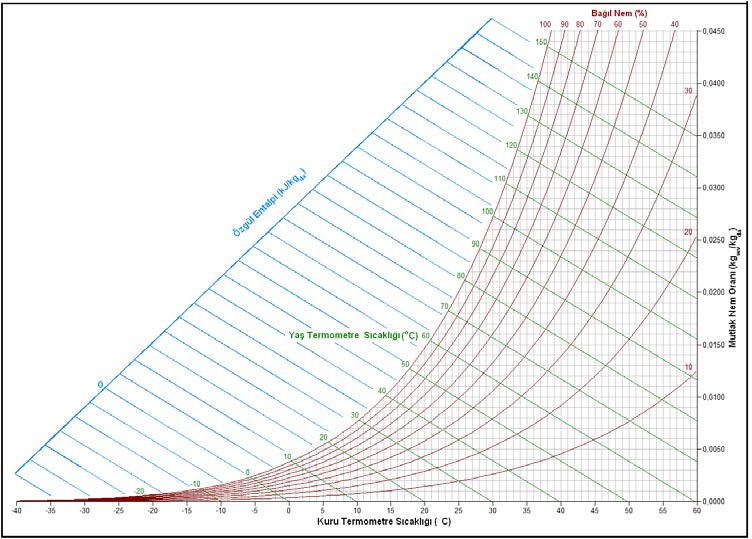
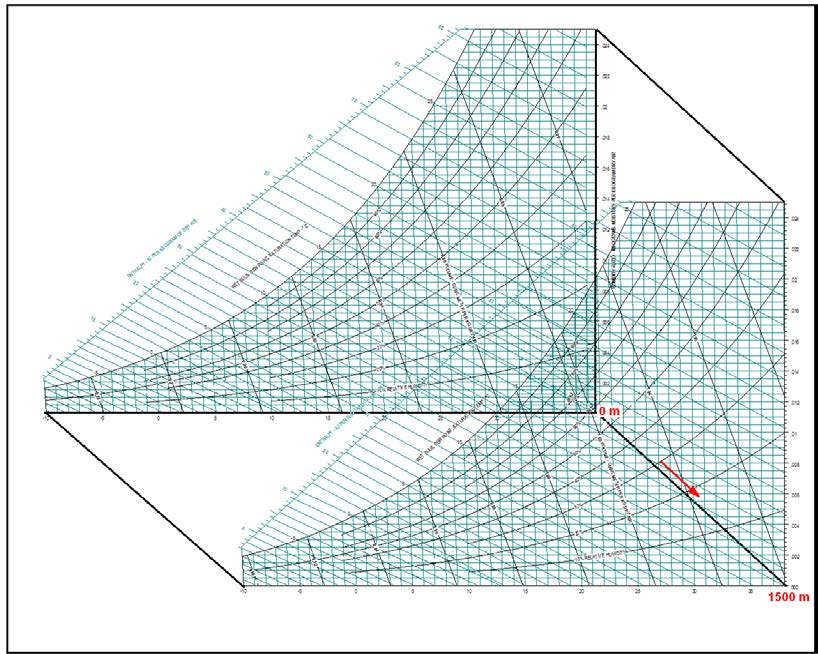
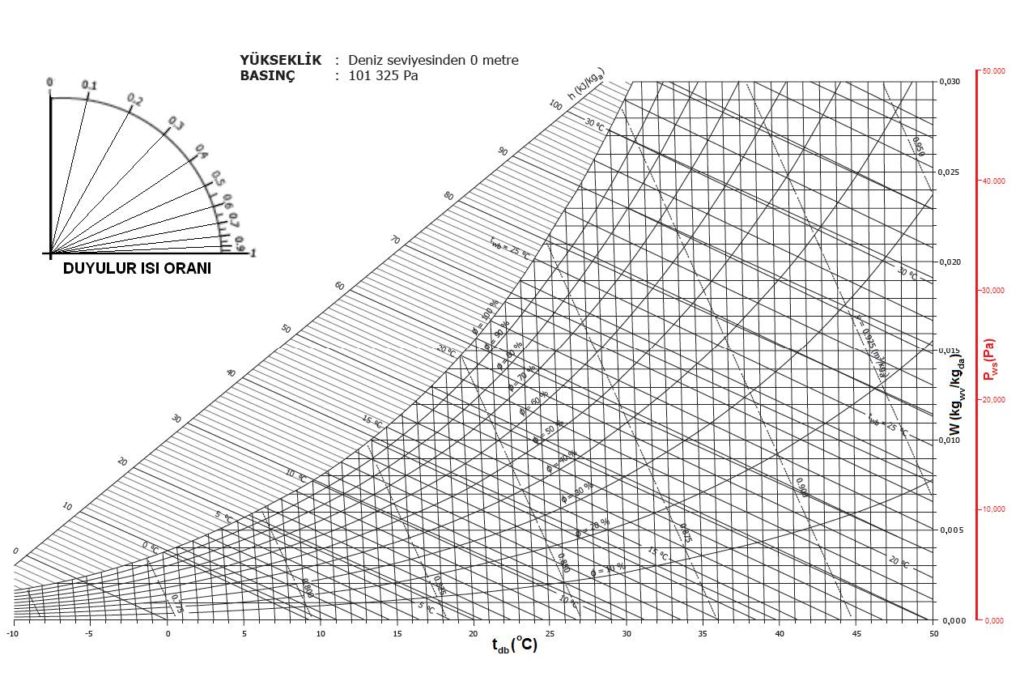

 3.2. Kuru Termometre Sıcaklığı
3.2. Kuru Termometre Sıcaklığı















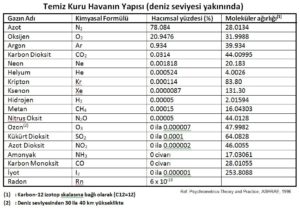
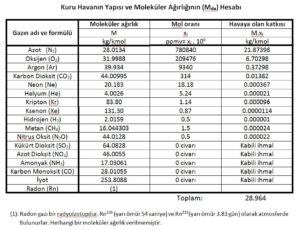
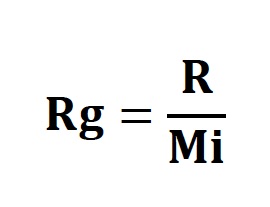 Bu duruma göre azot, oksijen ve kuru havanın gaz sabitleri şu şekilde bulunur:
Bu duruma göre azot, oksijen ve kuru havanın gaz sabitleri şu şekilde bulunur: